三生国健抗体SSGJ-705在中国获批II期临床研究
三生国健(.SH)公告称,近日,公司已收到4份国家食品药品监督管理局批准下发的《药物临床试验批件》,公司将于近期开展相关临床试验。此外,公司在国庆节前宣布其双特异性抗体SSGJ-705获准在中国临床使用。短短10天,三生国健已获批5个临床试验,涉及3个创新药,公司研发进度进入快车道。路。
其中,重组抗PD-1人源化单克隆抗体SSGJ-609A和抗HER2单克隆抗体分别获得批件,同意开展治疗HER2阳性乳腺癌的临床试验,具体为:评价及与妥珠单抗的比较联合帕妥珠单抗、化疗、PD-1 mAb联合伊妥珠单抗、帕妥珠单抗、化疗和伊妥珠单抗联合帕妥珠单抗、化疗在新的一项随机、开放标签、平行对照的II期临床研究中辅助治疗的疗效和安全性早期 HER2 阳性乳腺癌患者。

此外,SSGJ-609A还获得了两项临床批件,其中一项是同意开展II期临床研究,具体为:重组抗PD-1人源化单克隆抗体注射液(609A)联合盐酸评价单多柔比星治疗转移性/不可切除的未指明软组织肉瘤的疗效和安全性的臂、开放标签、多中心 II 期临床研究。
二是同意就609A联合贝伐单抗辅助经动脉化疗栓塞(TACE)对比TACE一线治疗不适合根治性治疗的肝细胞癌(HCC)的安全性和有效性进行II/III期研究。临床研究。
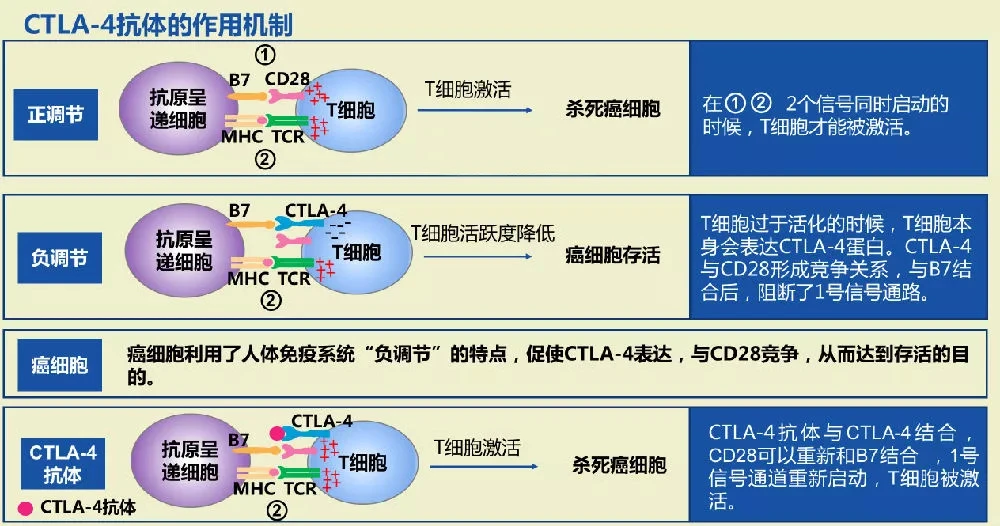
公告显示,重组抗PD-1人源化单抗注射液(609A)为中美双报抗PD-1人源化单抗产品,已在中国开展I期临床试验。美国和中国同时。(®)于2020年6月获得国家食品药品监督管理总局的正式批准。2020年12月末,通过医保谈判首次被纳入国家医保目录。今年4月,伊妥单抗被纳入CSCO乳腺癌诊疗指南,成为抗HER2治疗全过程的基础药物。
值得一提的是,根据9月29日的公告,公司双特异性抗体注射液SSGJ-705已获得国家食品药品监督管理局批准下发的《药物临床试验批件》,将进行I期临床试验。在不远的将来。. 此前,该药物于 6 月获得了美国食品和药物管理局的 IND。
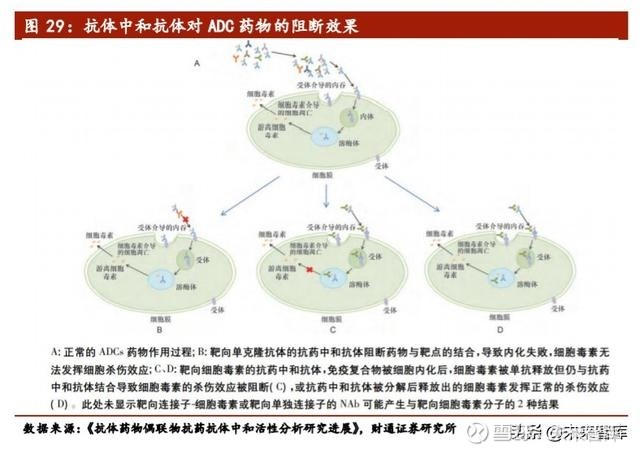
公司研发的抗PD1双特异性抗体(SSGJ-705))是一种同时靶向HER2和PD1的双特异性抗体(简称“BsAb”),将HER2靶向治疗与免疫检查点PD1阻断相结合。BsAb治疗与HER2阳性实体瘤相结合,与单克隆抗体相比,具有直接抗肿瘤和免疫激活的双重协同作用,是治疗晚期转移性HER2阳性肿瘤的一种新型且具有潜力的治疗方法。有望为HER2阳性实体瘤提供更好的解决方案。
本文来自格隆汇
威海链 » 三生国健抗体SSGJ-705在中国获批II期临床研究
免责声明:本文由提供互联网分享,不代表本网的观点和立场;如有侵权请联系删除。
