观察贝伐珠单抗联合-6化疗方案治疗中晚期结肠癌患者的效果
SCI论文( ):
【摘要】 目的:观察贝伐单抗联合-6化疗方案治疗晚期结肠癌患者的疗效。方法:选取87例晚期结肠癌患者为研究对象,按照随机数字表法分为观察组44例和对照组43例。对照组采用-6化疗方案治疗,观察组在对照组基础上采用贝伐单抗治疗。疾病控制率、血管内皮生长因子-A(VEGF-A)、血管内皮生长因子和受体-2(-2))、人可溶性肿瘤坏死因子相关凋亡诱导配体()水平、发生率不良反应和2年生存率。结果:
【关键词】 贝伐单抗;-6 化疗方案;结肠癌; 存活率
0 前言
结肠癌是发生在直肠和乙状结肠交界处的恶性肿瘤[1]。早期无明显临床症状,患者就诊时常发展至中晚期,失去最佳手术时机。(奥沙利铂+氟尿嘧啶+亚叶酸)治疗晚期结肠癌患者,但不良反应明显[2-3]。贝伐单抗是一种靶向抗癌药物,能有效抑制癌细胞的生长并诱导其凋亡[4]。本文观察贝伐单抗联合-6化疗方案治疗晚期结肠癌患者的疗效。
1 材料与方法
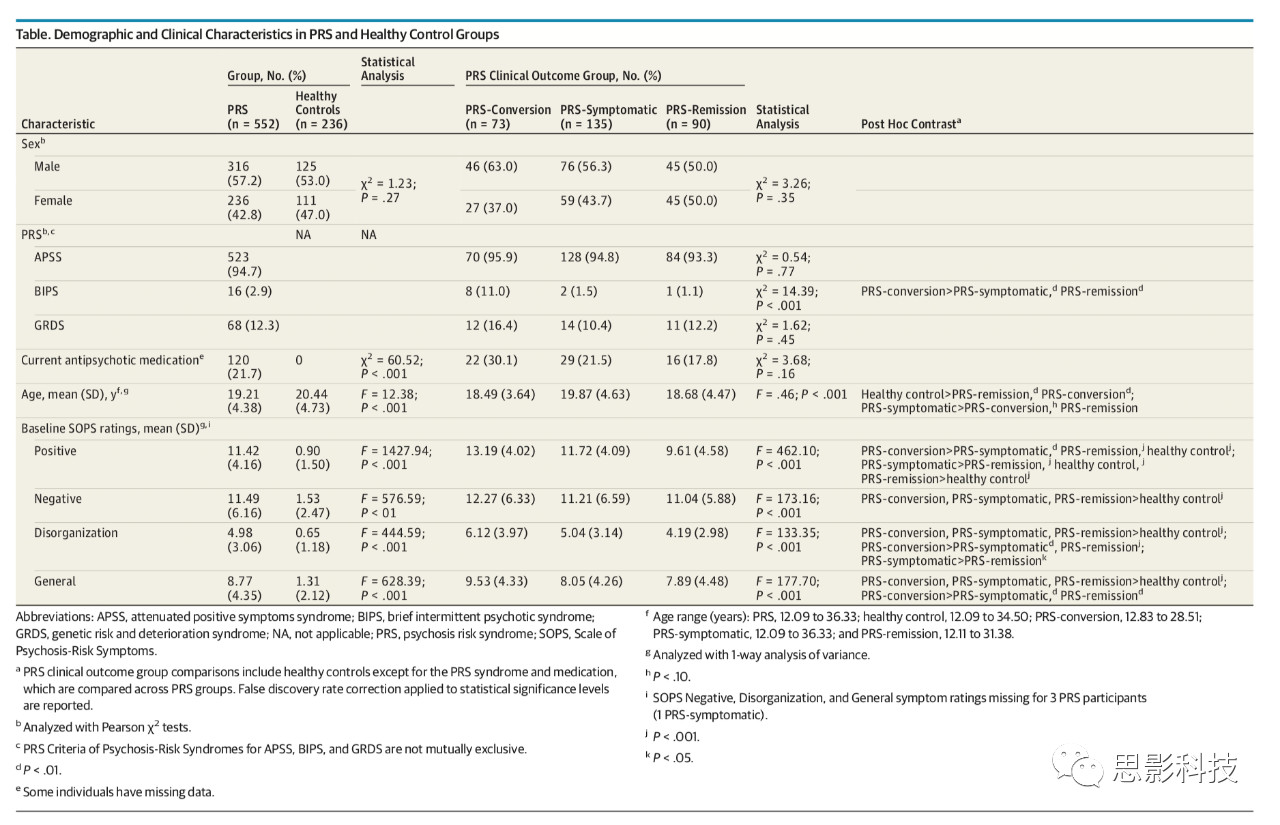
1.1 一般资料 选取2018年3月至2019年3月我院收治的87例晚期结肠癌患者为研究对象。纳入标准:经CT或MRI等影像学检查及病理检查结果确诊,符合结肠癌诊断标准[5];临床 III-IV 期;卡诺夫斯基评分(KPS)≥60分,预期生存期≥3个月。排除标准:严重肝肾功能不全患者;有放化疗史的患者;有化疗禁忌症的患者。患者及家属了解本研究内容并自愿签署知情同意书,本研究获得我院伦理委员会批准(批号:2018-001-019)。按随机数字表法分为观察组44例)对照组43例。观察组男24例,女20例;年龄37~71岁,平均(57.44±8.27)岁;临床分期:Ⅲ期26例,Ⅳ期18例。对照组男22例,女21例;年龄37~69岁,平均(57.83±8.16)岁;临床分期:有III期28例,IV期15例,两组一般资料差异无统计学意义(P>0.05),具有可比性。观察组男24例,女20例;年龄37~71岁,平均(57.44±8.27)岁;临床分期:Ⅲ期26例,Ⅳ期18例。对照组男22例,女21例;年龄37~69岁,平均(57.83±8.16)岁;临床分期:有III期28例,IV期15例,两组一般资料差异无统计学意义(P>0.05),具有可比性。观察组男24例,女20例;年龄37~71岁,平均(57.44±8.27)岁;临床分期:Ⅲ期26例,Ⅳ期18例。对照组男22例,女21例;年龄37~69岁,平均(57.83±8.16)岁;临床分期:有III期28例,IV期15例,两组一般资料差异无统计学意义(P>0.05),具有可比性。对照组由22名男性和21名女性组成;年龄37~69岁,平均(57.83±8.16)岁;临床分期:Ⅲ期28例,Ⅳ期15例. 两组一般资料差异无统计学意义(P>0.05),具有可比性。对照组由22名男性和21名女性组成;年龄37~69岁,平均(57.83±8.16)岁;临床分期:Ⅲ期28例,Ⅳ期15例. 两组一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 方法对照组给予-6化疗方案。第一天,注射用奥沙利铂(江苏恒瑞医药有限公司,国药控股,50mg)85mg/m2,静脉滴注;亚叶酸钙注射液(江苏恒瑞医药有限公司,国药控股)准子,10 mL:0.1g)400 mg/m2,静脉滴注,每日一次,连用5天;氟尿嘧啶注射液(亚宝药业集团有限公司,国药准字,10 mL:0.25 g)400 mg/m2静脉滴注3~5天,每次静脉滴注时间不得缩短超过 6~8 小时。每2周为一个化疗周期,连续治疗3个周期。
观察组在对照组基础上给予贝伐单抗注射液[()有限公司,注册号,]5mg/kg,首日静脉滴注。每2周给药一次为一个周期的化疗,持续治疗3个周期。
比较两组不良反应发生率。(4)两组随访2年,比较两组生存率。
1.4 统计方法采用SPSS 21.0软件进行统计分析,计量资料以(x—±s)表示,采用t检验,计数资料以率(%)表示, χ2 用于检验,P
2 个结果
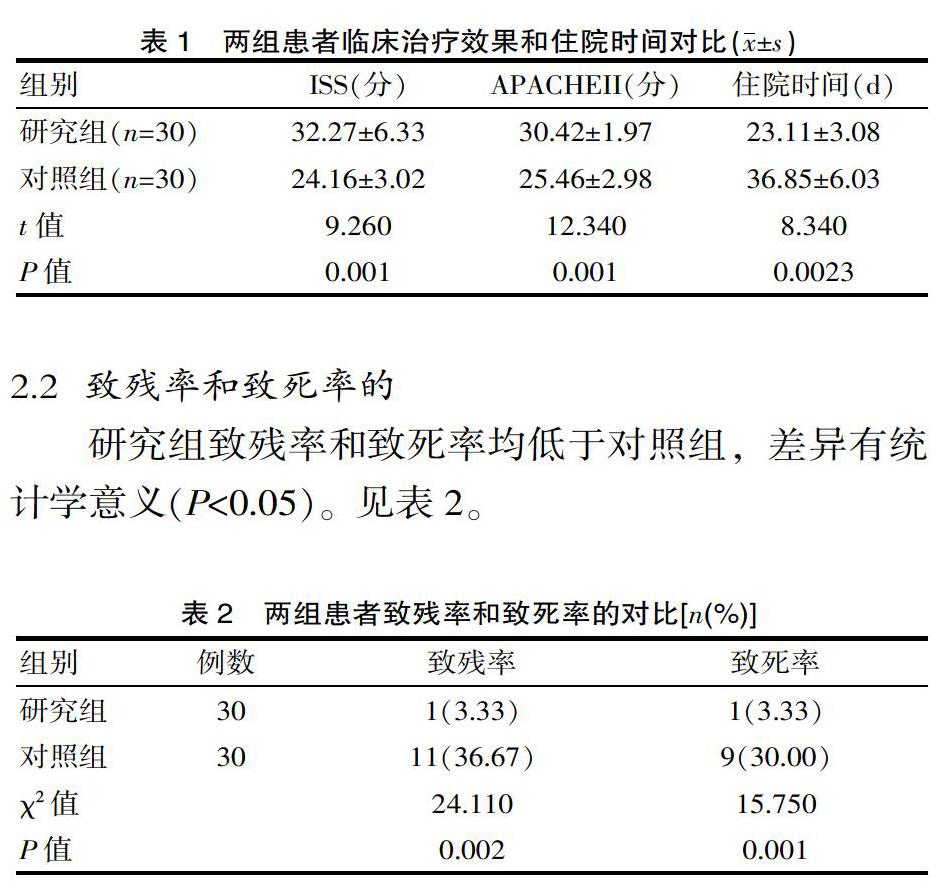
2.1 两组疾病控制率比较观察组疾病控制率为81.82%(36/44),明显高于对照组的6< @2.79%) (27/43),差异有统计学意义(P
2.2 两组治疗前后VEGF-A、-2、VEGF-A水平差异无统计学意义(P>0.05)@ >;治疗后,两组VEGF-A、-2水平低于治疗前,观察组高于对照组,两组高于治疗前,观察组高于治疗前与对照组相比,差异有统计学意义(P
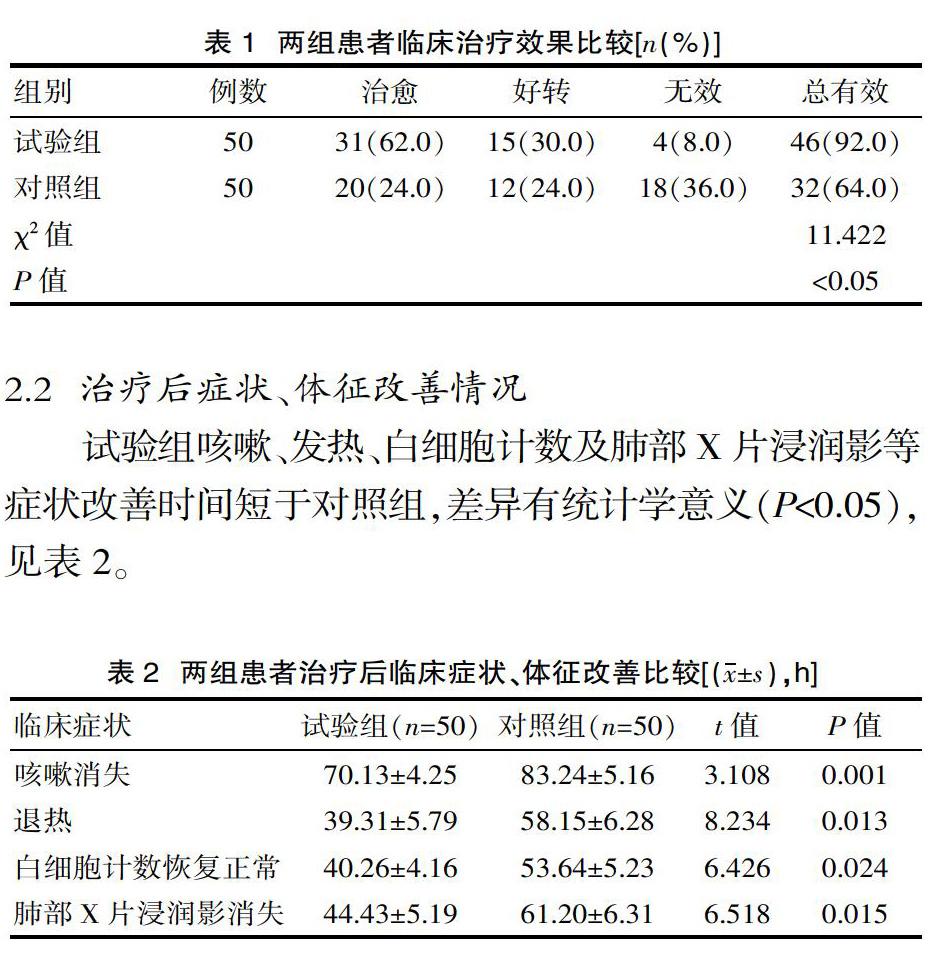
2.3 两组不良反应发生率差异无统计学意义(P>0.05)。见表3。
2.4 观察组2年生存率为70.45%,明显高于对照组(48.84%),差异具有统计学意义(P
3 讨论
晚期结肠癌患者接受-6化疗方案可以抑制癌细胞的DNA复制,促进其凋亡,从而改善患者的临床症状[6-7]。但单独使用-6化疗效果不理想,患者长期生存率低[8]。
本研究结果显示,观察组疾病控制率高于对照组,2年生存率高于对照组。原因是贝伐单抗注射液通过抑制肿瘤微血管的形成,减少血液供应,从而抑制肿瘤生长,提高治疗效果[9]。已知血清VEGF-A和-2是预测肿瘤状况和评价治疗效果的指标[10],可阻断VEGF诱导的血管生成[11]。本研究结果还显示,观察组血清VEGF-A、-2水平低于对照组,高于对照组。分析的原因是贝伐单抗是针对VEGF的单克隆抗体,能在一定程度上抑制肿瘤细胞中VEGF的产生,减少肿瘤微血管的产生,从而改善结肠癌患者的预后[12]。本研究结果还显示,两组的不良反应发生率差异无统计学意义,提示联合贝伐单抗治疗并未增加安全风险。
综上所述,贝伐单抗联合-6化疗治疗晚期结肠癌患者,可提高疾病控制率、2年生存率和水平,降低VEGF-A和-2水平,效果更佳。比单独的-6。化疗方案治疗。
参考
[1] 周芳,王建军,程传耀,等。贝伐单抗联合方案治疗晚期结肠癌的临床观察[J]. 中国医药, 2017, 28 (23): 3261-3265.
[2] 石磊. 贝伐单抗联合-6化疗方案治疗转移性结肠癌[J]. 医学新闻, 2017, 27 (4): 402-403.
[3] 曹然华,苏武云,邱莹,等。贝伐单抗联合化疗治疗晚期结直肠癌的临床疗效[J]. 现代生物医学进展, 2015, 15 (2): 277 -280.
[4] 周芳,王建军,程传耀,等。贝伐单抗联合方案治疗晚期结肠癌的临床观察[J]. 中国医药, 2017, 28 (23): 3261-3265.
[5] 中华人民共和国卫生和计划生育委员会医管局、医院管理局,中华医学会肿瘤学分会。中国结直肠癌诊疗标准(2017年版)[J]. 中华外科杂志, 2018, 56 (4) : 241-258.
[6] 罗文杰,刘明华,罗晓丽,等。贝伐单抗注射液治疗晚期结肠癌的临床研究[J]. 中国临床药理学杂志, 2018, 34(12): 1407-1409.
[7] 陈志勇,陈真,邱金华,等。贝伐单抗联合方案治疗晚期结肠癌的临床疗效及对血清CEA的影响[J]. 中国医学, 2017, 7 (10) : 11-14.
[8] 钟丽,赵志. 贝伐单抗抑制自噬促进结肠癌细胞生长抑制和凋亡诱导[J]. 现代肿瘤学, 2017, 25 (3): 345-35 1.
[9] 曾茹,陈立林,叶黄阳,等.贝伐单抗靶向治疗转移性结肠癌的临床研究[J]. 中国生化医学杂志, 2016, 36 (7): 155 -157.
[10] 姜华峰,应晓江,陈洪亮,等。血管内皮生长因子-A表达与结直肠癌淋巴管密度和微血管密度关系的研究[J]. 中华全科医学,2016,14(11):1870-1872.
[11] M、MP、Tura A 等人。与 RPE 中的 VEGF-A/-2 [J]. , 2016 (83):210-216.
[12] 李志峰,刘金忠,史荣亚,等。尾部同源框转录因子2和环氧合酶-2、血管内皮生长因子在结肠癌组织中的表达[J]. 临床实用医学杂志, 2017, 21 (5):79-82.
关注SCI论文的创作和发表,寻求SCI论文修改、SCI论文发表等服务支持,请锁定SCI论文网站!
威海链 » 观察贝伐珠单抗联合-6化疗方案治疗中晚期结肠癌患者的效果
免责声明:本文由提供互联网分享,不代表本网的观点和立场;如有侵权请联系删除。
