能延长患者生存,最成功的免疫治疗药物是免疫检查点抑制剂
三阴性乳腺癌 (TNBC) 占所有乳腺癌的 15%-20%。它具有高度侵袭性,表现为早期复发和转移。转移性TNBC的全身治疗以化疗为主,但缓解持续时间通常较短,中位总生存期(OS)为12~18个月。迫切需要改善治疗。其他实体瘤研究已经证实免疫治疗可以延长患者的生存期,最成功的免疫治疗药物是免疫检查点抑制剂(ICIs)。() 发表的一篇综述阐明了 ICI 和其他新型免疫治疗药物在 TNBC 中的应用。此外,还讨论了免疫治疗的生物标志物以及未来TNBC免疫治疗的发展方向。
介绍
TNBC 的几个关键特征使其比其他乳腺癌亚型更可能对免疫疗法产生反应。首先,TNBC 有更多的肿瘤浸润淋巴细胞 (TIL)。在其他肿瘤中,更多的 TILs 与更好的 ICIs 反应相关,高水平的 TILs 与早期 TNBC 的预后更好相关;其次,TNBC肿瘤细胞和免疫细胞均表达较高水平的PD-L1,为ICIs提供了直接靶点,而其他肿瘤中PD-L1的表达也与抗PD-1治疗的反应有关;最后,TNBC有更多的非同义突变,可以产生更多的肿瘤特异性新抗原可以激活新抗原特异性T细胞,而ICIs可以增强这个过程。
数字。三阴性乳腺癌的免疫及联合治疗
ICI单药治疗
虽然ICIs治疗TNBC的有效率高于激素受体阳性和HER2阳性乳腺癌,但疗效仍然很低。未选择患者的单药缓解率约为 5%,新治疗的 PD-L1 阳性患者的单药缓解率约为 23%。. 在 PD-1 抑制剂 () 的早期 Ib-012 研究中,32 名接受治疗和新治疗的 PD-L1 阳性总体反应率 (ORR) 18.5%,然而,在随后的 II 期 -086 研究 (),170 名既往接受过治疗且未选择 PD-L1 的患者的 ORR 为 5.3%。值得注意的是,84例初治患者的ORR为21.4%,表明ICIs在一线治疗中更有效。III-119 期研究 () 进一步支持了这一结论。在研究中,
PD-L1 抑制剂和 也可以作为单一药物治疗。Ib期研究()中,58例接受多线治疗的患者ORR5.2%,而研究()中,115例既往接受过治疗的患者ORR为10%在 PD-L1 阴性亚组中未观察到治疗反应。两项研究都强调了 ICIs 单药治疗的疗效有限,且先前治疗的转移性疾病的反应率特别低。
桌子。三阴性乳腺癌免疫单药治疗的相关研究
免疫治疗联合化疗
PD-1/L1抑制剂联合化疗比单药ICIs更有效。-1 该研究 () 包括 106 例过去接受过 0-2 线治疗的转移患者,无论是 PD-L1 阳性还是 PD-L1 阴性。给予帕博利珠单抗联合艾日布林治疗。ORR为26.4%,艾日布林是一种微管抑制剂,可以抑制与从肿瘤中去除CD8阳性T细胞相关的转化生长因子β。同样,一项 Ib 期研究 () 招募了 33 名先前接受过 0~2 线治疗并接受了 联合白蛋白结合紫杉醇治疗的患者。ORR 为 39.4%。一个有希望的结果可能与紫杉醇对 Toll 样受体活性和树突细胞活化的促进有关。在随机 III 期研究 () 中,新治疗的患者接受阿特珠单抗联合白蛋白结合紫杉醇治疗。PD-L1阳性亚组的OS较对照组增加7个月。有显着差异,但整个队列没有显着差异,这一点需要注意,因为研究的分层设计需要整体获益才能检测亚组效应。上述结果促使FDA和欧盟委员会批准联合白蛋白结合型紫杉醇治疗PD-L1阳性,这是首个获批的乳腺癌免疫疗法。但整个队列没有显着差异,这一点需要注意,因为研究的分层设计需要整体获益才能检测亚组效应。上述结果促使FDA和欧盟委员会批准联合白蛋白结合型紫杉醇治疗PD-L1阳性,这是首个获批的乳腺癌免疫疗法。但整个队列没有显着差异,这一点需要注意,因为研究的分层设计需要整体获益才能检测亚组效应。上述结果促使FDA和欧盟委员会批准联合白蛋白结合型紫杉醇治疗PD-L1阳性,这是首个获批的乳腺癌免疫疗法。
几项正在进行的研究将进一步阐明化疗联合 ICI 在治疗中的作用。-355 ()近日宣布,与单独化疗相比,一线联合化疗可显着改善PD-L1阳性PFS。PD-L1 阳性临界值是综合评分≥10。PD-L1检测使用22C3抗体,综合评分是所有表达PD-L1的细胞(肿瘤细胞、淋巴细胞和巨噬细胞)与所有肿瘤细胞的比值。目前,正在招募两项化疗± 的研究。该研究()旨在阐明一线阿特珠单抗联合紫杉醇是否能提高单药紫杉醇的疗效;
桌子。免疫联合治疗相关研究成果
早期TNBC免疫治疗联合化疗
ICIs 联合化疗治疗早期 TNBC 也取得初步成功。在 I-SPY 2 研究 () 中,对于 II 至 III 期疾病的患者,在新辅助治疗(紫杉醇、多柔比星、环磷酰胺)中加入派姆单抗,估计病理完全缓解率(pCR)从 22 % 增加到 60 %,几乎增加了 3 倍。这一结果可能与蒽环类药物的免疫刺激作用有关,它可以增加肿瘤中的免疫效应细胞、抗原摄取和加工。该研究 () 包括早期的 T1b 疾病。结果显示,在新辅助治疗(白蛋白结合紫杉醇、表柔比星、环磷酰胺)中加入并未显着提高总体pCR率,仅在化疗前2周使用时pCR率有所提高,但是这个亚组分析没有达到显着差异。-522研究()报告,加入新辅助治疗(紫杉醇+卡铂,蒽环类+环磷酰胺),随后手术,辅助治疗9个周期,pCR率从51.2%提高到6% 4.8%,18 个月无事件生存率 (EFS) 从 85.3% 增加到 91.3%(危险比 [HR] 0.@ >63, 95%CI 0.@>43~0.@>93)。这个结果需要长期随访证实,并权衡长期免疫治疗相关毒性。研究,淋巴结阴性患者受益较少,
但这些结果表明,5药方案在-522研究中的应用值得进一步探索。这些相反的结果可能与化疗的配伍性不同有关。该研究还包括蒽环类药物,表明阿霉素作为诱导剂在增强PD-1阻断敏感性方面具有优势;也可能与不同ICIs的活性有关,因为PD-1抑制剂也可以阻断PD-L2。这种机制的差异是否可以转化为临床疗效的差异尚不清楚。也可能与不同ICIs的活性有关,因为PD-1抑制剂也可以阻断PD-L2。这种机制的差异是否可以转化为临床疗效的差异尚不清楚。也可能与不同ICIs的活性有关,因为PD-1抑制剂也可以阻断PD-L2。这种机制的差异是否可以转化为临床疗效的差异尚不清楚。
几项正在进行的早期疾病研究将进一步阐明 ICI 在 TNBC 新辅助和辅助治疗中的作用。两项关键研究正在评估 1 年辅助抗 PD-1/L1 治疗是否可以延长 EFS 或无病生存期(DFS):SWOG/研究()使用派姆单抗治疗残留病患者,A 研究()采用高危或残留疾病患者的治疗。另外两项大型研究正在评估在新辅助和辅助治疗中加入 是否可以延长 EFS 或无创 DFS:安慰剂对照 B-59 研究 () 在新辅助治疗中加入 四药化疗,然后是 辅助治疗一年; 该研究()将在新辅助三药化疗中加入阿替珠单抗,然后再进行阿替珠单抗辅助治疗或观察一年。一项小型研究正在探索在新辅助化疗中仅添加 是否可以改善结果。研究 () 在新辅助白蛋白结合紫杉醇、多柔比星和环磷酰胺的基础上加入阿替珠单抗与单独化疗相比是否可以获得更高的 pCR 率。
桌子。早期三阴性乳腺癌联合免疫治疗研究
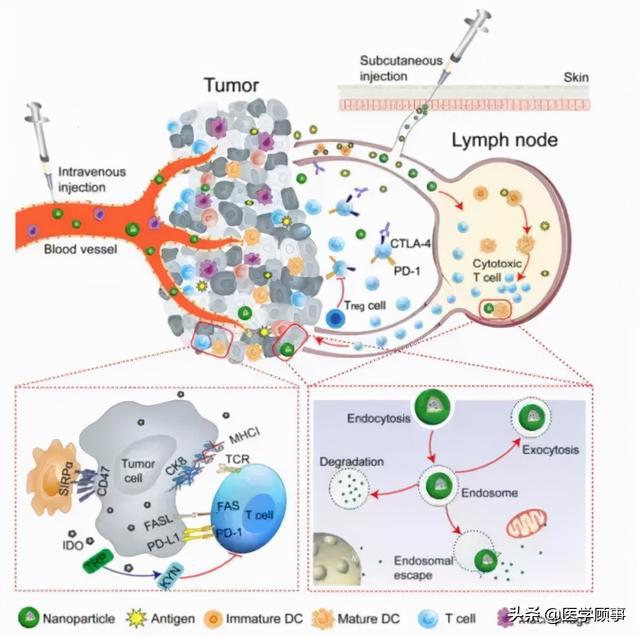
免疫治疗联合靶向治疗
免疫治疗和靶向治疗的结合正在成为克服 PD-1/L1 抑制剂耐药性的潜在策略。BRCA 缺陷型 TNBC 模型中的临床前证据表明,PARP 抑制剂可以增加细胞质 DNA 并激活蛋白质(干扰素基因刺激因子,增加肿瘤中的 1 型干扰素和 T 细胞浸润)。人乳腺癌转化研究也表明,/2突变与免疫原性标志物呈负相关,如免疫浸润和T细胞介导的细胞溶解。后者计算为 CD8 阳性 T 细胞效应器 PRF1 和 GZMA 的总和。II期研究()拟评估PARP抑制剂联合PD-1抑制剂的疗效,55例晚期TNBC或ORR为47%,其中15例BRCA突变患者的中位PFS8.3个月。ORR 略低于接受单药 PARP 抑制剂治疗的中胚系 BRCA 突变 TNBC 患者的 () 和 () 研究的 ORR,分别为 55% 和 62%,但中位 PFS 优于这两项研究的 TNBC 亚组( 5.5 和 5.8 个月)。研究中的患者 () 有种系 BRCA 突变,并接受了奥拉帕利联合杜伐珠单抗治疗。ORR 为 58.8%,中位 PFS 为 4.9 个月。单药PARP抑制剂的治疗结果相似。非随机设计、不同的 PARP 抑制剂和小样本限制了这些研究的最终结论。更大的研究 () 和 DORA 研究 () 正在进行中,
AKT 抑制剂是另一种重要的靶向治疗药物,目前正在研究与 ICI 联合治疗 TNBC。肿瘤抑制因子 PTEN(AKT 的负调节因子)的缺失与对免疫疗法的抗性有关。AKT 抑制可以增加具有记忆细胞表型的肿瘤特异性淋巴细胞。紫杉醇+AKT抑制剂+阿替珠单抗的Ib期研究的初步数据显示,前26名患者的ORR为73%,无论/AKT1/PTEN状态和PD-L1表达如何,反应相似。这些数据促使III期研究()使用紫杉醇+治疗,研究()使用AKT抑制剂+紫杉醇+的组合。
MEK抑制剂结合检查点阻断也值得探索。TNBC的临床前研究表明,MEK抑制可以上调PD-L1和主要组织相容性复合物的表达,增强PD-1/L1抑制的抗肿瘤免疫反应。II期研究()包括63名患者,最初接受治疗,给予MEK抑制剂+PD-L1抑制剂+紫杉醇和++白蛋白结合型紫杉醇治疗,ORR为34.4%和 29.0%,中位 PFS 分别为 3.8 和 7.0 个月,但研究目的 PD-1 阻断联合 MEK 抑制和紫杉醇治疗可增加疗效。
桌子。三阴性乳腺癌免疫联合靶向治疗的主要结果
新的免疫治疗药物
迫切需要新的治疗策略来改善 TNBC 抗肿瘤免疫治疗的结果。其中一种策略是 IL-2 通路激动剂(NKTR-214),它可以优先激活 IL-2b 受体并扩增效应 T 细胞而不是调节性 T 细胞。I/II-02 期研究 ( ) 38入组患者并接受(NKTR-214)联合治疗,ORR为13.2%,无论PD-L1表达如何,均有持续缓解。结合。PD的研究-1/L1抗体和化疗治疗TNBC正在进行中,另一个策略是toll样受体9(TLR9)激动剂SD-101,可刺激浆细胞样树突状细胞)释放干扰素-α并成熟为抗原-提呈细胞,增加肿瘤中 CD8 阳性 T 细胞的浸润。
乳腺癌疫苗是另一种增强抗癌免疫力的新治疗策略。乳腺癌肽通过疫苗呈递给T细胞,增强T细胞的活化,进而增强癌细胞的免疫识别。目前有许多研究单独使用乳腺癌疫苗或与 PD-1/L1 抑制剂联合用于 TNBC 辅助治疗或转移性疾病的治疗。这些疫苗包括PVX-410疫苗(、)、叶酸受体α疫苗()和新抗原疫苗。PVX-410 疫苗的目标是 TNBC 过表达的 XBP1 和肽。叶酸受体 α 疫苗的靶点也是一种在乳腺癌中过度表达的肽。在乳腺癌和卵巢癌的 I 期研究中,免疫反应持续了至少 12 个月。
乳腺癌疫苗靶向的肿瘤细胞的过表达肽也在正常细胞中表达,但新抗原疫苗靶向的肽来源于肿瘤特异性突变,具有肿瘤特异性,在正常细胞中不表达,所以T细胞对这些新抗原的反应不受自身耐受性的限制。一项随机 I 期研究 () 招募了 24 名在新辅助治疗后有残留疾病的 TNBC 患者,并给予新抗原疫苗 ± 杜伐珠单抗;另一项随机 II 期研究 () 包括 70 名初始患者 患者在随机化前接受了白蛋白结合紫杉醇 + 杜伐珠单抗 ± 新抗原疫苗治疗、吉西他滨 + 卡铂治疗 18 周,并使用下一代测序和表位预测算法确定患者特异性新抗原并进行优先排序,疫苗的目的是使 T 细胞能够识别特异性表达新抗原的癌细胞。上述乳腺癌疫苗是否能引发足够的抗肿瘤免疫反应并改善临床结果仍有待确定。
TNBC 目前正在探索的其他免疫治疗策略包括溶瘤病毒和过继细胞治疗(TIL 输注和 CAR-T 细胞)。目前正在开发一种用于治疗 TNBC 的溶瘤病毒。在 II 期研究中,患者接受了原位溶瘤病毒(腺病毒介导的单纯疱疹病毒胸苷激酶表达)+伐昔洛韦+立体定向放疗+派姆单抗治疗()。另一项研究正在探索 TIL 输注在乳腺癌中的作用。TIL(识别肿瘤特异性新抗原的 T 细胞)是从患者的肿瘤中获得的,被激活和放大,然后输回。一例化疗难治性激素受体阳性转移病例 乳腺癌患者在输注靶向四种肿瘤特异性突变蛋白的 TIL 后获得持续完全缓解。
针对肿瘤抗原的工程化 CAR-T 细胞也被用于乳腺癌治疗研究。应采取充分的安全措施以防止可能危及生命的不良事件。在一项研究 () 中,6 例转移性乳腺癌接受了 c-MET CAR-T 细胞转染 mRNA 的瘤内注射,不良反应不超过 1 级。另一项研究 () 打算纳入 36 例先前接受过对于已治疗的转移性乳腺癌,CAR-T 细胞疗法以间皮素为靶点,在其他肿瘤中具有治疗反应且无毒。
虽然这些新的免疫疗法还需要更多的验证,但它们无疑会增加对乳腺癌抗肿瘤免疫疗法的认识,为有效的免疫疗法的发展做出贡献。
预测免疫治疗反应的标志物
需要预测 TNBC 免疫疗法益处的生物标志物来选择最有可能从单药 ICI 中受益的患者,并开发联合疗法以克服 ICI 耐药性。只有 2 个经过验证的生物标志物:错配修复缺陷和免疫细胞中的 PD-L1 表达。然而,错配修复缺陷在乳腺癌中很少发生,早期疾病更为常见;大多数 PD-L1 阴性(SP-142),而 PD-L1 作为生物标志物的表达受到以下几个方面的限制:PD-L1 的表达因时间和转移部位的不同而有很大差异;不同的PD-L1 检测方法,尤其是在染色免疫细胞时;一些 PD-L1 阴性患者对 ICI 有反应;
TNBC 免疫治疗反应的潜在生物标志物包括高肿瘤突变负荷 (TMB)、TIL 和免疫浸润转录特征。尽管高 TMB 与 PD-1/L1 抑制剂治疗反应相关,但不同类型癌症的高 TMB 阈值差异很大。具有高 TMB>10 突变/Mb 的乳腺癌很少见:3% 的原发性肿瘤和 8% 的转移性肿瘤。研究()表明,单药治疗既往接受过多线治疗的TMB≥9突变/Mb转移性乳腺癌的ORR为21%,与单药的临床获益一致。 ICI 治疗高 TMB 乳腺癌。在一项对 62 名接受过抗 PD-1/L1 治疗的患者的回顾性研究中,TMB≥10 突变/Mb 与 ICI 治疗获得的更长 PFS 相关,而 PTEN 变化与较短的 PFS 相关。这些发现需要得到验证,并且需要阐明 PTEN 变化的预测和预后影响。
高水平的 TIL 与更好的 ICI 单药治疗反应相关。-119 最近的一项研究证明,TILs ≥5% 可以独立预测派姆单抗单药治疗比化疗具有更好的治疗反应和生存率。患者过去接受过 1 至 2 线全身治疗。同样,在一项研究中,新辅助治疗使用杜伐珠单抗 + 白蛋白结合型紫杉醇 + 剂量密集型阿霉素和环磷酰胺治疗 57 名早期 TNBC 患者。结果显示高CD8阳性细胞密度和免疫基因表达特征和DNA损伤反应特征与较高的pCR率相关,但这些变化并不是ICI治疗患者的特异性变化。该研究 () 在单药纳武单抗治疗之前使用了多种诱导方案。结果显示,阿霉素或顺铂治疗可增加与 PD-L1 通路、T 细胞毒性和炎症相关基因的表达,提示某些化疗药物可诱导良好的肿瘤免疫微环境变化,促进对 PD-1 阻断的治疗反应。需要更多的转化研究来阐明与免疫治疗反应相关的因素在乳腺癌其他肿瘤中的作用,例如抗原呈递和干扰素-γ 信号传导。
未来方向
虽然+白蛋白结合紫杉醇已获批用于治疗PD-L1阳性,但关于TNBC的免疫治疗仍有许多未解决的问题。有必要开发针对 PD-L1 阴性或 PD-1/L1 治疗耐药的免疫疗法,并制定降低免疫疗法相关毒性的策略。了解免疫治疗反应和耐药机制对于促进TNBC免疫治疗的发展非常重要。
参考
TE,SM。in-.J Natl Canc Netw 的作用。2020;18(4):479-489. doi:10.@>6004/.2020.@>7554
威海链 » 能延长患者生存,最成功的免疫治疗药物是免疫检查点抑制剂
免责声明:本文由提供互联网分享,不代表本网的观点和立场;如有侵权请联系删除。
